林业发展局第483号报告

在检查结束时,当调查人员观察到他们认为可能构成违反《食品药品和化妆品法》及相关行为的任何情况时,会向公司管理层发放FDA表。对该行业来说,了解FDA483表中所列的信息是很重要的。本研究报告将对FDA表483进行个案研究,方法是对每一项观察进行分类,重新确定审计员检查的信息种类,并建议对其中一项观察进行CAPA。
关键词:林业发展局,表格483,案例研究、观察,CAPA
1.简要概述
在检查结束时,当调查人员观察到他们认为可能构成违反《食品药品和化妆品法》及相关行为的任何情况时,会向公司管理层发放FDA表。对该行业来说,了解FDA483表中所列的信息是很重要的。
本文将对FDA表483进行案例研究。在2009年5月nt4日nt至5月14日期间,史崔克仪器组。林业发展局的四名审计员对斯特赖克公司进行了检查。在林业发展局第483号表格的最后审计报告中,共有10项意见。
本研究报告旨在对各项观察进行分类,再现审计员检查的信息种类,以确定偏差,并提出一种观察方法。
2.观察结果分类
2.1药品质量系统分系统
现代药品质量体系有生产系统、设备设备系统、实验室控制系统、材料系统、包装标签系统六个子系统。林业发展局表483所列的观察结果见附录1,对表1所列的一个或多个子系统有影响。从表1中发现,每一项观察都与质量子系统相关。这是因为质量体系作为它的中心子系统,为其他五个子系统提供基础,并帮助它们实现合规。
2.2偏离转基因点
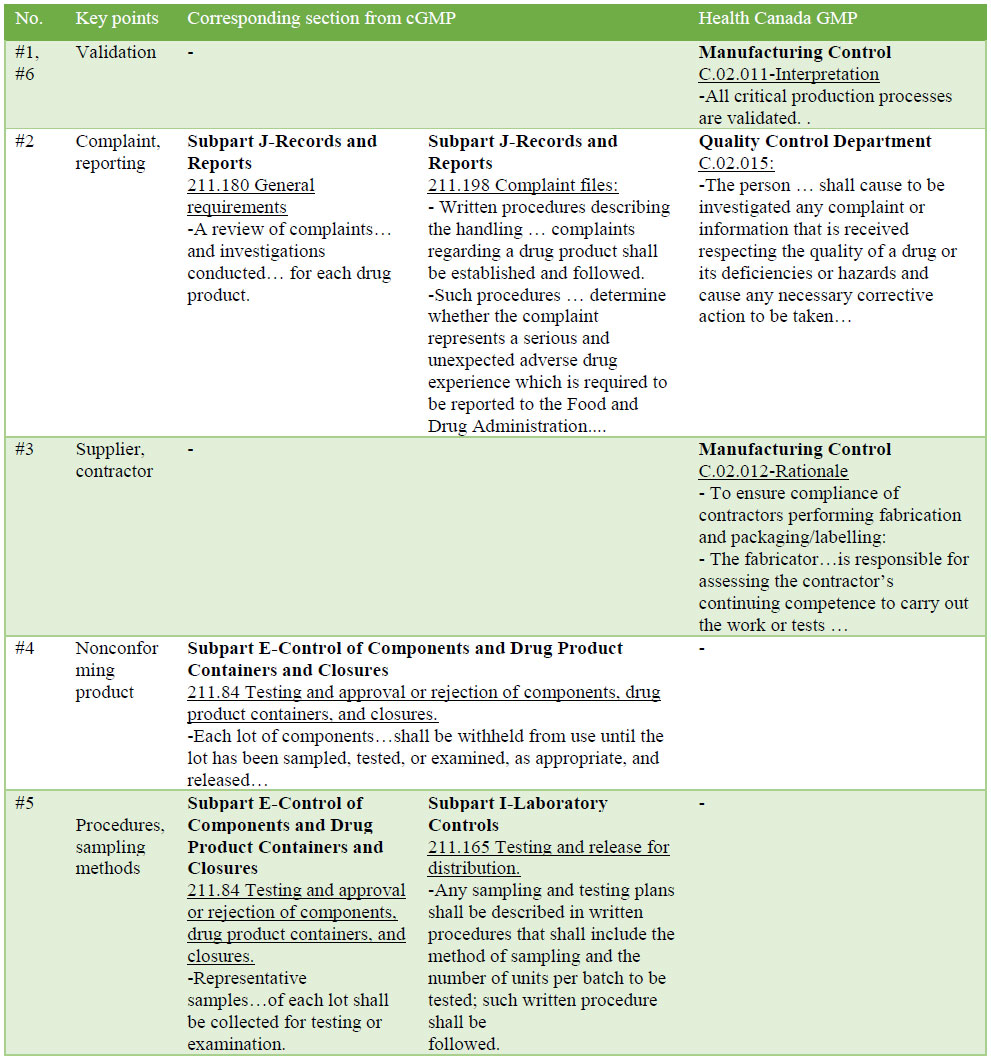
FDA表格483中的观察结果是根据CGMP得出的,CGMP是"第211-部分目前的成品药品的良好制造做法"。观察是指检查员在检查过程中注意到的对转基因点的偏差或不足。表2概述了加拿大卫生部关于CGMP的说明以及与观察结果相应的GMP条例。
3.审计员核查的资料
检查期间,审计员检查了文件,以确定偏差。下表3重新生成了审计员检查过的可能信息。在这次检查中,审计员检查了许多文件,但似乎侧重于验证和遵守的文件。
4.会议管理局关于观察的建议
例如,建议对第1项意见采取纠正和预防行动如下:
纠正行动:
*对三叶草导尿管和银外导尿管的制造过程进行重新验证;
*对生产三叶草导管和银管管的挤出过程进行重新验证。
预防行动:
审查流程重新验证的操作程序,与FDA的指导方针(流程验证:一般原则和做法)相比较,以确定缺口并相应提高操作程序;
*根据流程验证的标准作业程序审查所有流程验证报告,并在发现缺口时进行重新验证。
表1:观察对药品质量体系的影响
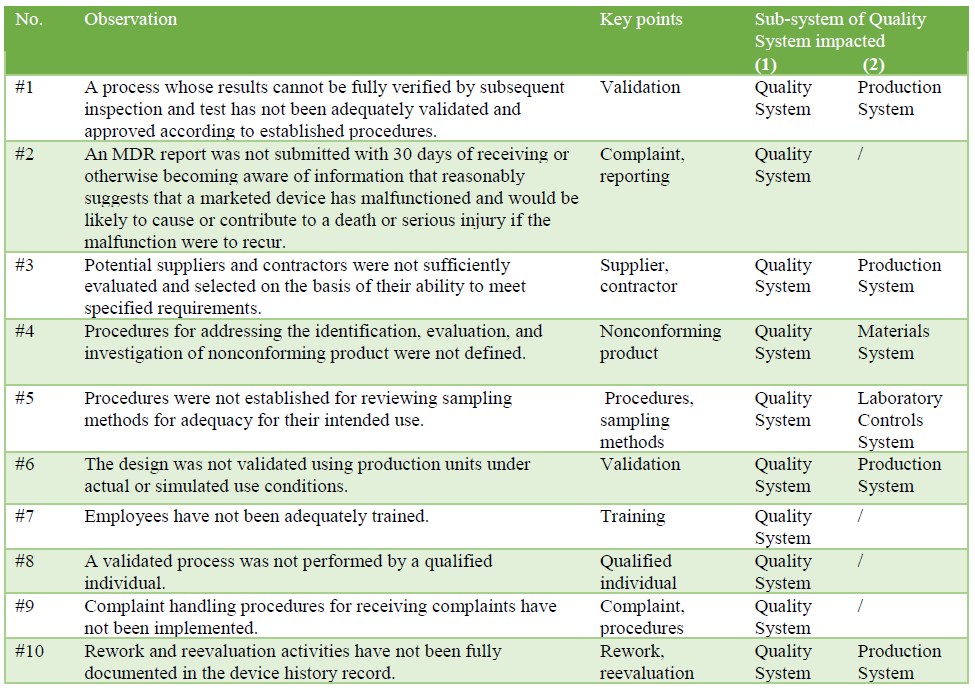
表2:与加拿大卫生部和林业发展局相比的偏离情况
 http://www.hownature.cn/NewsDetail.aspx?ID=26
http://www.hownature.cn/NewsDetail.aspx?ID=26
Table 2: Deviations to cGMP(FDA) and GMP(Health Canada) (cont.)
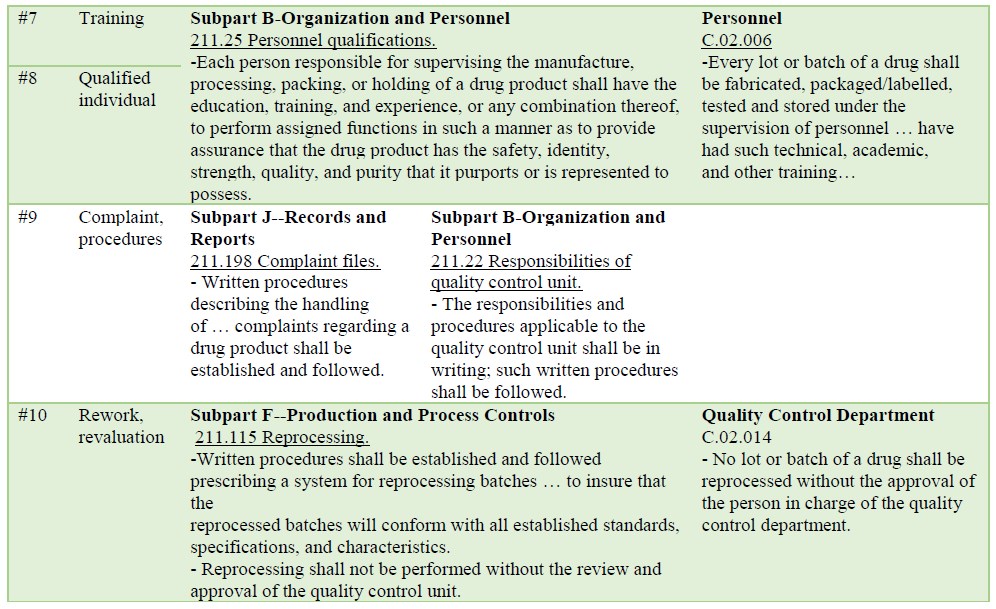
表3:审计员核对的资料
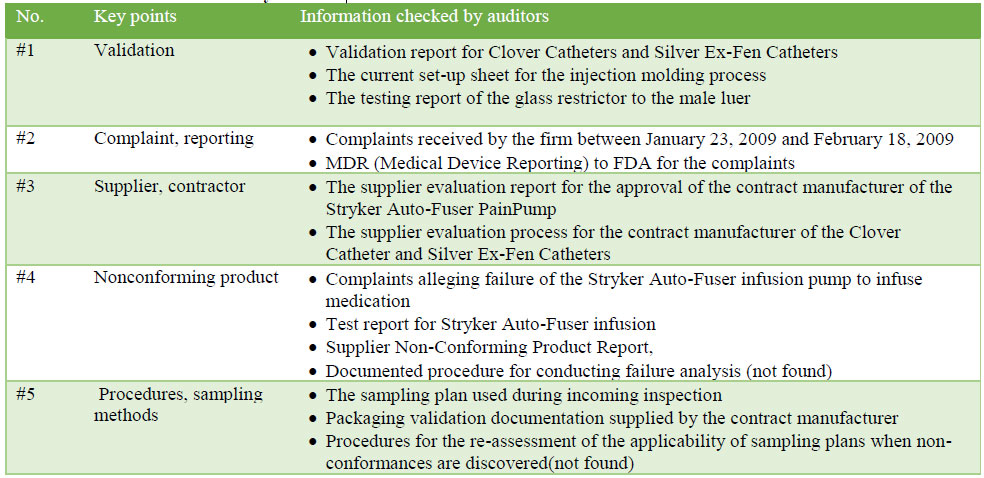
表3:审计员核对的资料(续))

参考文献
[1] FDA Form 483 Frequently Asked Questions. https://www.fda.gov/iceci/inspections/ucm256377.htm
[2] Stryker Instruments. Kalamazoo, MI. Form 483 (Inspectional Observations). 5/04/09 – 5/14/09. https://www.fda.gov/downloads/AboutFDA/CentersOffices/OfficeofGlobalRegulatoryOperationsandPolicy/ORA/ORAElectronicReadingRoom/UCM172096.pdf
[2]强制性报告要求:制造商、进口商和设备使用者设施。医疗器械和引导系统/市场后要求/报道广告/违约。
[3]药品质量体系的六个子系统。玛克辛K。失败。制药质量系统----六个子系统/4585/
[4]第211-现行成品药品的良好制造惯例,《联邦条例法典》第21编。林业发展局。政府/脚本/Cdrh/cfdos/cffr/cfr搜寻?c.c.f=211
[5] Good Manufacturing Practices (GMP) Guidelines – 2009 Edition, Version 2 (GUI-0001).Health Canada. http://www.hc-sc.gc.ca/dhp-mps/compli-conform/gmp-bpf/docs/gui-0001-eng.php
[6]良好制造做法风险分类(GMP)观测意见。
[7]过程验证:一般原则和做法。林业发展局。2011年1月n